近期,四川局、浙江局和安徽局均发布飞检通报,共2659家生产企业,其中,限期整改473家,不合格8家,1家存在严重缺陷。以下是相关内容
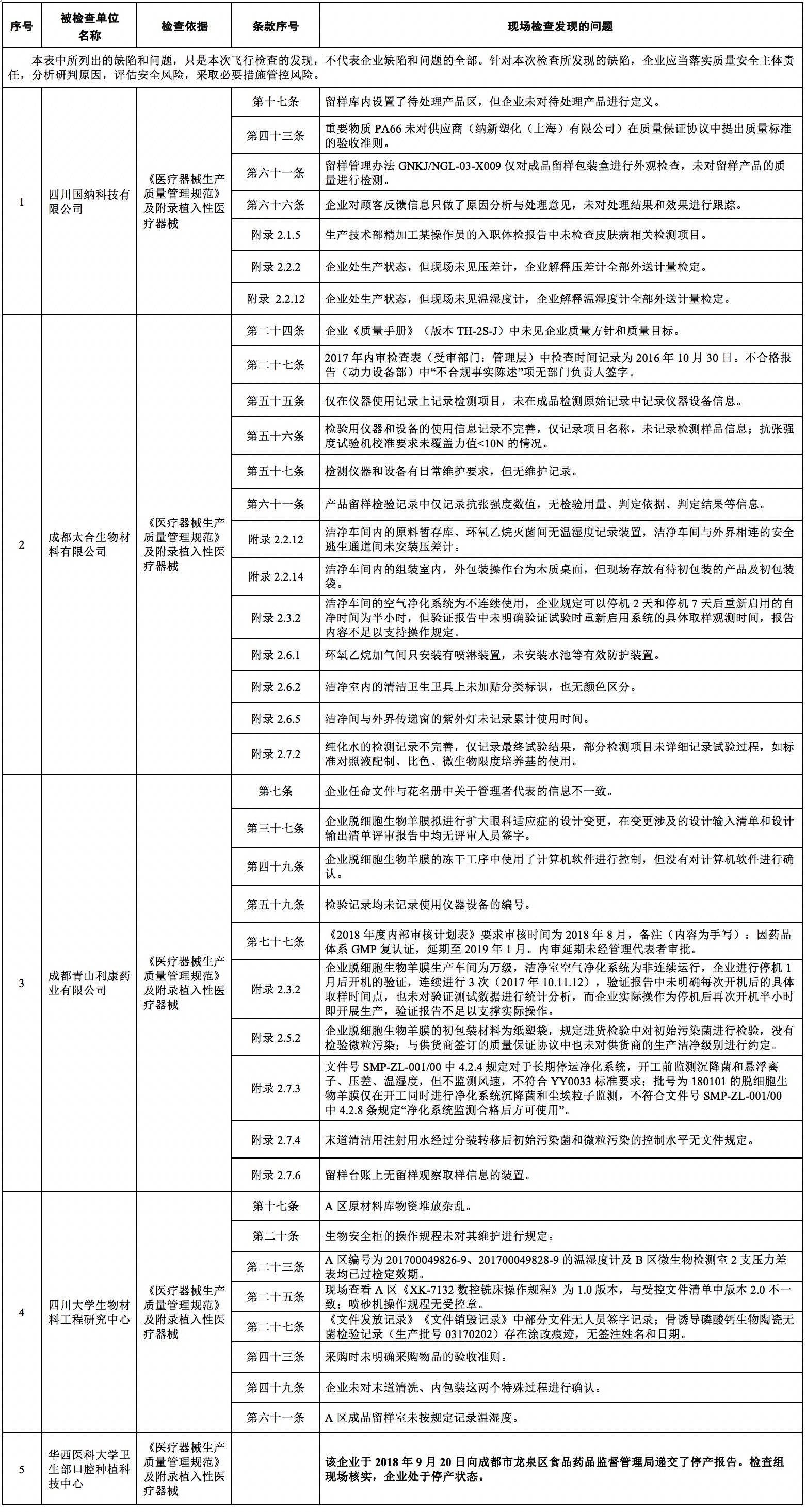
四川省药品监督管理局关于对四川国纳科技有限公司等5家单位飞行检查情况的通报
川药监发〔2018〕4号
各市(州)食品药品监督管理局:
2018年10月,原四川省食品药品监督管理局组织对四川国纳科技有限公司等5家单位进行了飞行检查,现将检查情况(详见附件)予以通报,请相关市(州)局督促企业落实整改并抓好跟踪检查。
一、针对华西医科大学卫生部口腔种植科技中心已经停止生产的事实,企业恢复生产前,应当经成都市食品药品监督管理局依据《医疗器械监督管理条例》《医疗器械生产质量管理规范》等相关要求检查合格后方可恢复生产。
二、针对在其他单位检查发现的问题,所在市(州)局应责成企业限期整改并进行跟踪检查,要求企业落实质量安全主体责任,分析研判原因,评估产品安全风险,采取必要措施管控风险。
三、各市(州)要按照“四个最严”要求,加大对医疗器械生产经营使用单位的监督检查力度,督促企业(单位)切实落实主体责任,认真贯彻《医疗器械生产质量管理规范》的要求,确保医疗器械产品安全有效。企业的整改情况及所在市(州)局采取的监管措施于2018年12月21日前书面报送至省局。
联系人:钟凯;电话:028-86785265。
附件:
医疗器械飞行检查情况.docx
四川省药品监督管理局
2018年11月21日
附件:
医疗器械飞行检查情况
浙江省药品监督管理局关于对宁波骏马医用器械有限公司等2家单位飞行检查情况的通报
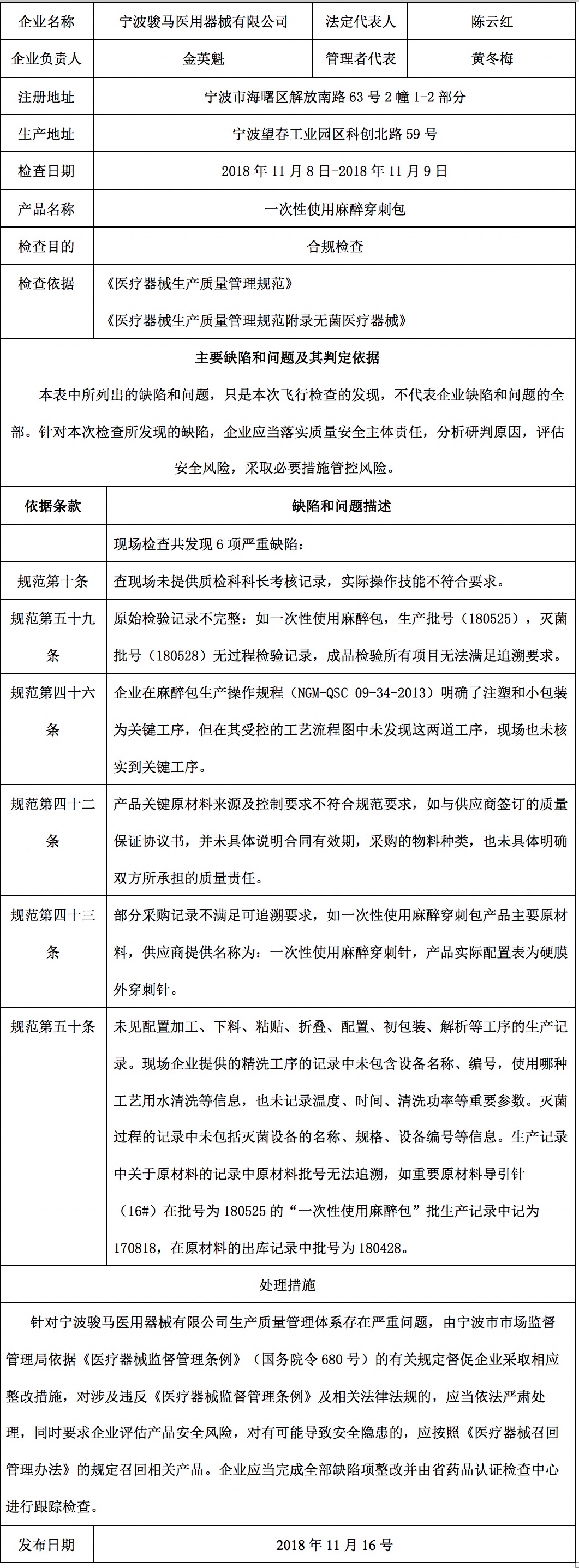
对宁波骏马医用器械有限公司飞行检查通报
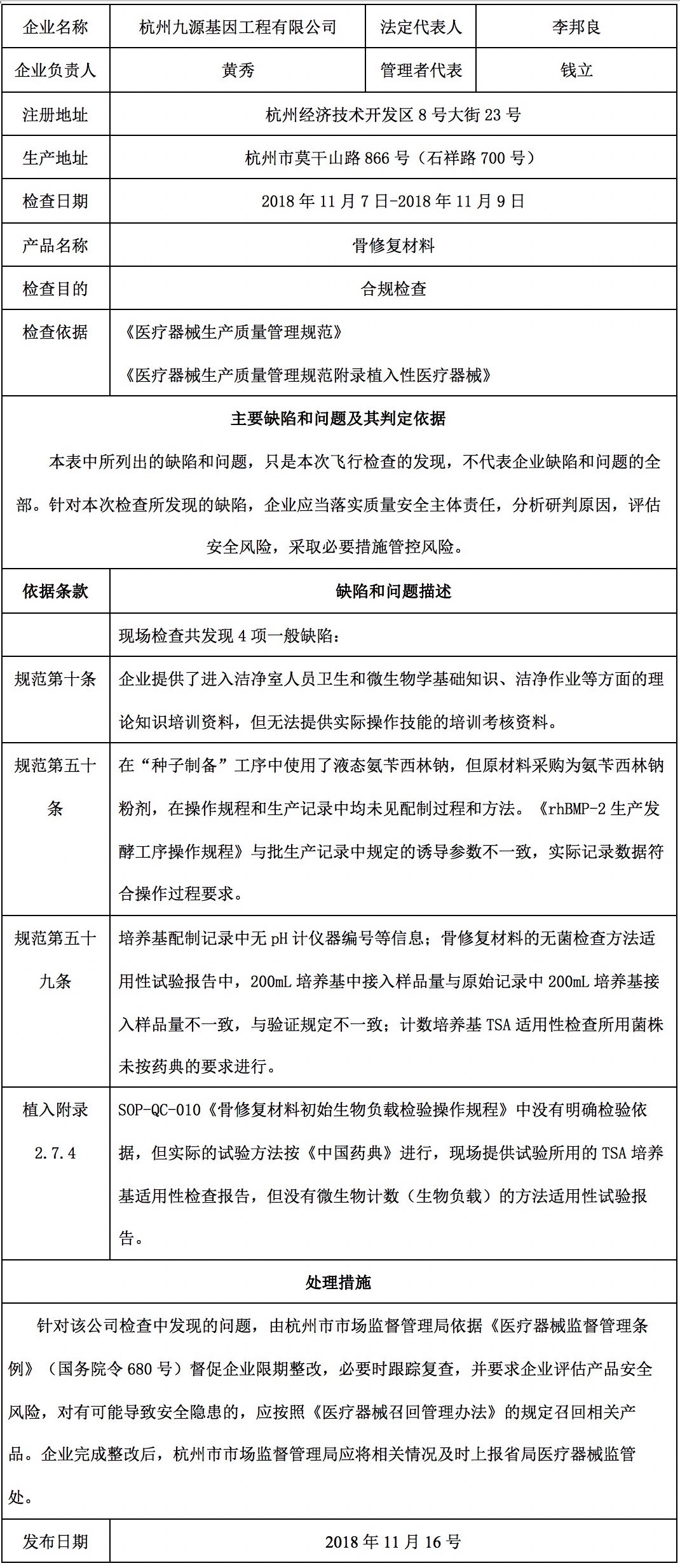
对杭州九源基因工程有限公司飞行检查通报
安徽省食品药品监督管理局医疗器械监督检查信息通告
日前,省食药监局公布医疗器械监督检查信息,在受检的2652家医疗器械企业中,限期整改472家,不合格8家。
8家不合格被查处
此次检查范围涉及全省医疗器械生产、经营企业和使用单位;检查形式为跟踪检查、日常检查和专项检查。
检查发现有7家经营企业不合格,分别是滁州华巨百姓缘大药房连锁股份有限公司萧县五店无《医疗器械经营许可证》经营第三类医疗器械“无菌笔式注射针”;安徽同春堂医药连锁有限责任公司怀远县祥和大药房未经备案经营二类医疗器械拒不整改;明光市远镜闻明眼镜店涉嫌无证经营医疗器械案;芜湖市正玉医疗用品有限公司未建立员工健康档案;芜湖欣瑞阳光医药有限公司的库房已发生变化,不能满足经营要求;枞阳县金猴大药房有限公司会宫店未取得经营许可证经营三类医疗器械;黄山市万众眼镜销售有限公司无相关制度、培训、未设立医疗器械专区、无从业人员健康证。
生产企业1家不合格,即安徽禾泰药业有限公司无生产设备。
472家有缺陷需整改
检查中,还有472家单位或企业因为存在各种管理缺陷而被责令整改:如肥东县宝岛眼镜有限公司验收记录、销售记录不符合要求;灵璧县大路民康大药房未建立培训档案,未定期检查、维护器械;唐集镇赵圩村卫生室购进发票不全;太和县新龙保健品有限公司销售记录不全;安徽韵天大药房连锁有限公司淮南人民北路店缺质量人员任命书;明光市自来桥镇桥南村卫生室无医疗器械验收记录;六安市金安区妇幼保健院未配备质量管理机构或人员;当涂中山医院质量管理制度不完善;芜湖县虔诚大药房无医疗器械培训档案、医疗器械有混放现象;泾县昌桥乡泉水村卫生室未建立不合格医疗器械台帐;铜陵市宝视吉眼镜有限公司购进三类医疗器械未索取供货单位资质证明;池州市大明眼镜行2018年度培训记录、养护记录不完整;安庆宏峰义齿制作中心生产设备应当有明显标识,防止非预期使用,烧洁炉检修状态未见标识;祁门县天下康中心药房有限公司医疗器械与非药品混放;广德蓝岛眼镜店计算机系统不完善;宿松县南北药行有限公司玉龙店培训记录不全等。