医疗器械产品注册技术审评报告(境内)
产品中文名称:瓣膜成形环
产品管理类别:三类
申请人名称:金仕生物科技(常熟)有限公司
国家食品药品监督管理总局
医疗器械技术审评中心
基本信息
一、申请人名称 金仕生物科技(常熟)有限公司
二、申请人住所 常熟经济技术开发区高新技术产业园盘锦北路9号
三、生产地址 常熟经济技术开发区高新技术产业园盘锦北路9号
产品审评摘要
一、产品概述
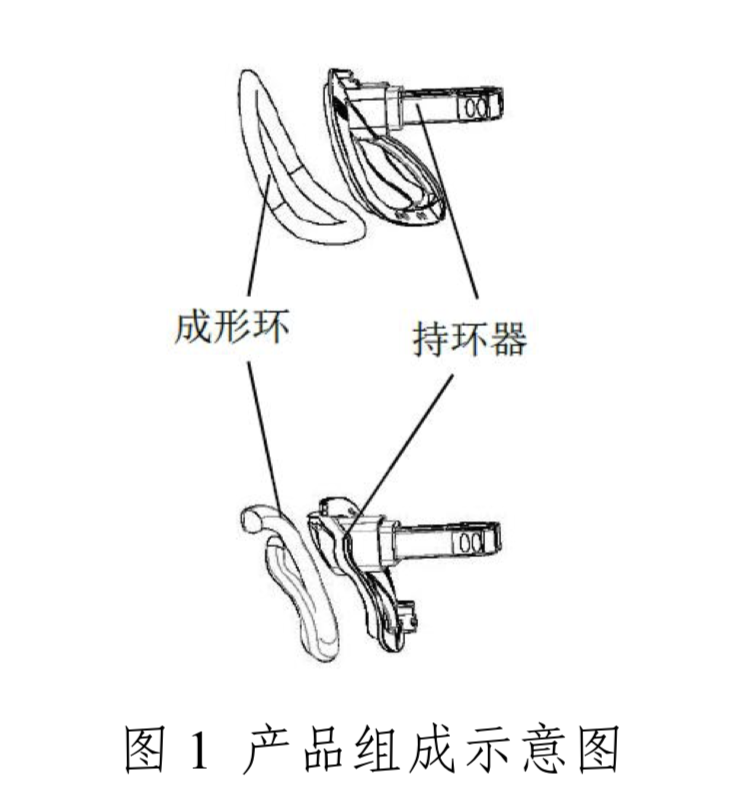
(一)产品结构及组成
产品由成形环和持环器组成,成形环由316LVM不锈钢、硅橡胶、聚酯布和聚酯缝线制成,316LVM材料有管材和丝材,管材用于成环,丝材用于二尖瓣成形环,将管材两端加固形成闭环结构。成形环采用硅橡胶材料作为中间层,外层为紧紧包裹着的聚酯布,聚酯布通过聚酯缝线与硅橡胶固定,聚酯布上还缝制有带颜色的标识线。持环器采用聚碳酸酯材料制成,通过尼龙绑线与成形环捆绑。产品一次性使用,经湿热灭菌。
(二)产品适用范围
该产品适用于纠正和重塑病变的瓣环,维持合理的瓣叶对合面积。适用于二尖瓣/三尖瓣等心脏瓣环修复手术需要使用人工成形环的患者。
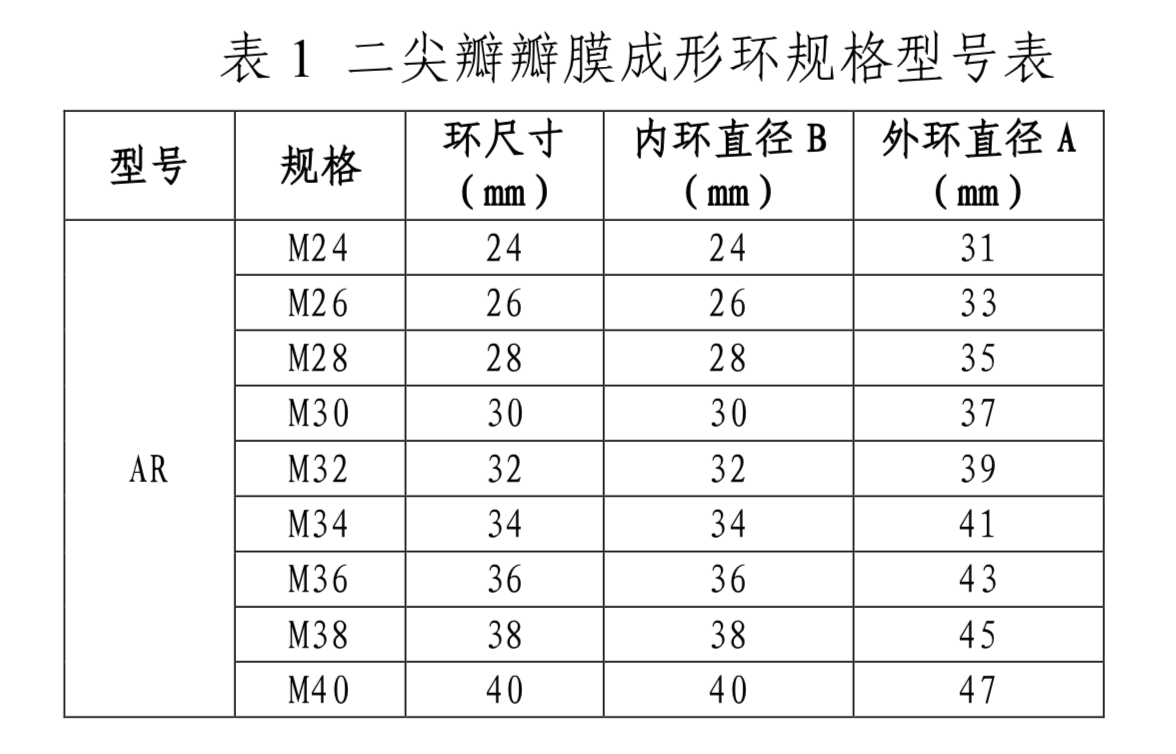
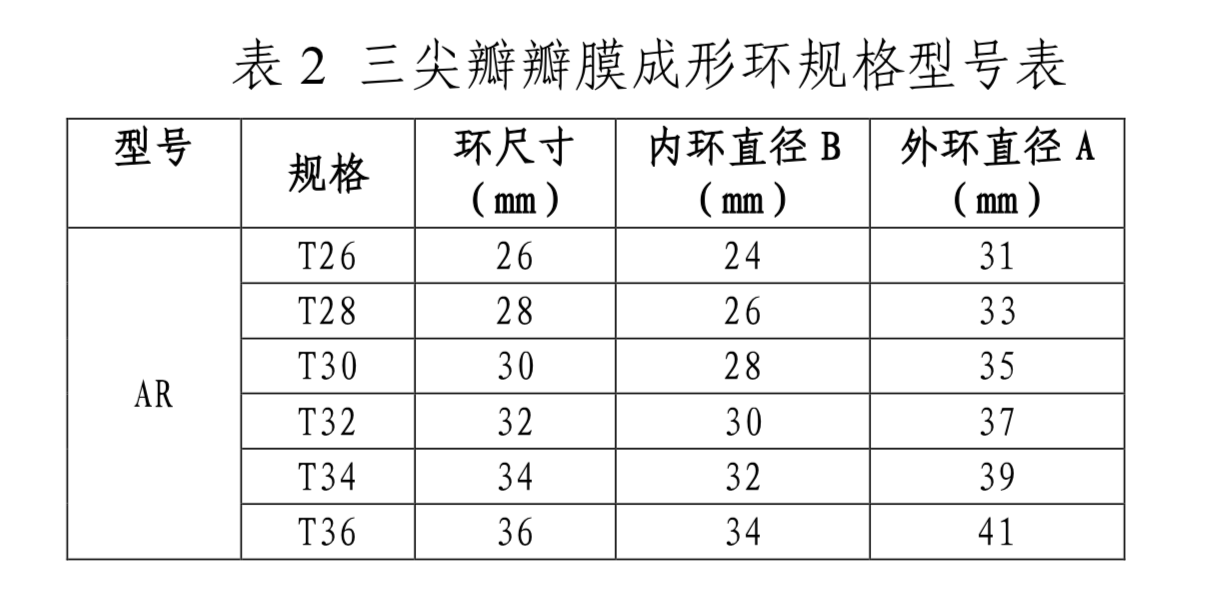
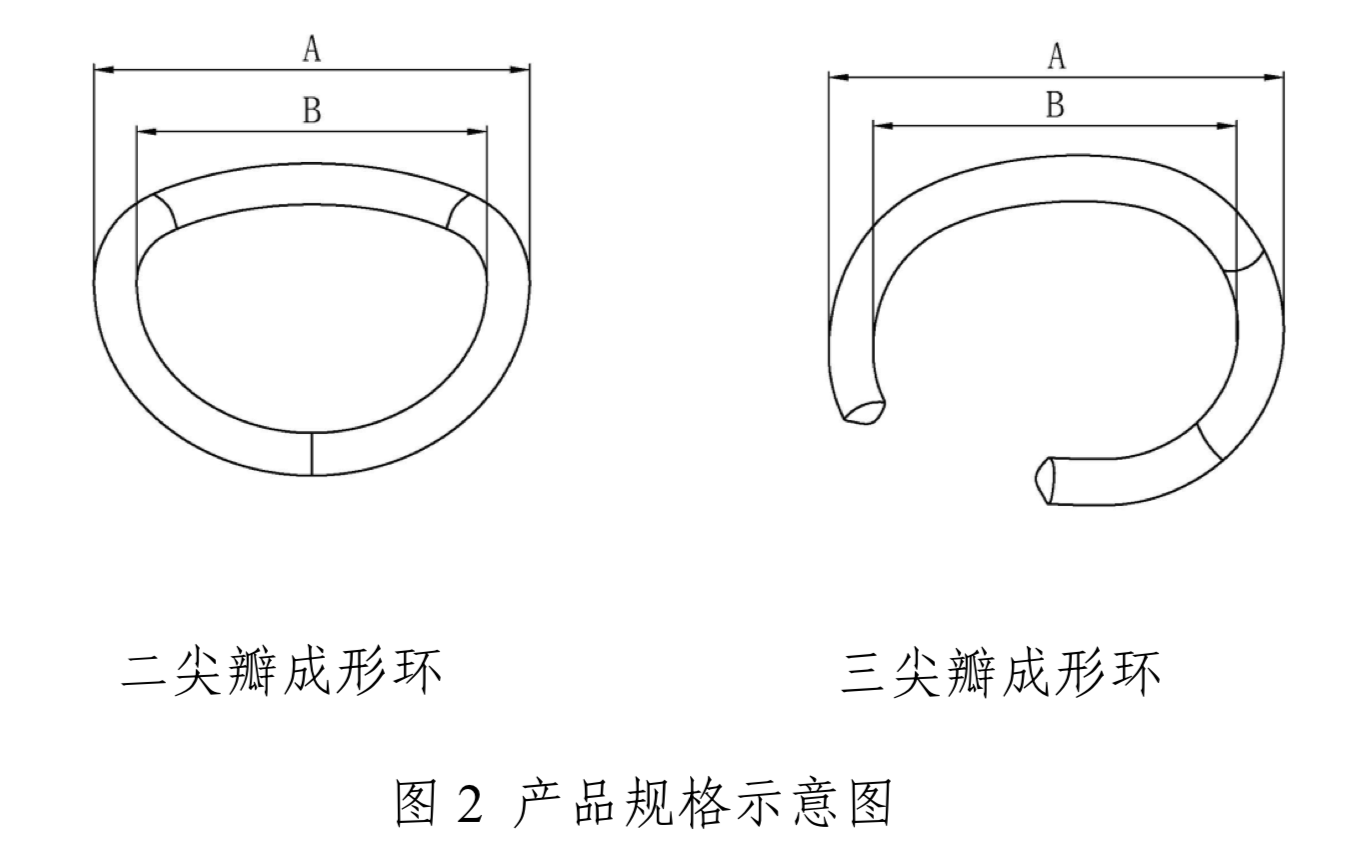
(三)型号/规格
产品的型号和规格参见表1、表2和图2。
(四)作用机理
该产品通过瓣膜成形术,对病变二尖瓣或三尖瓣进行修复,以恢复其形状、轮廓及生理功能,用于因疾病导致的二尖瓣和三尖瓣瓣叶闭合不完全所造成的心室返流。该产品采用三维双鞍及变螺距双螺旋结构设计,变螺距双螺旋渐变设计使前环和后环具有不同硬度,预期更符合瓣环的生理结构并优化瓣叶应力分布。
二、临床前研究摘要
(一)产品性能研究
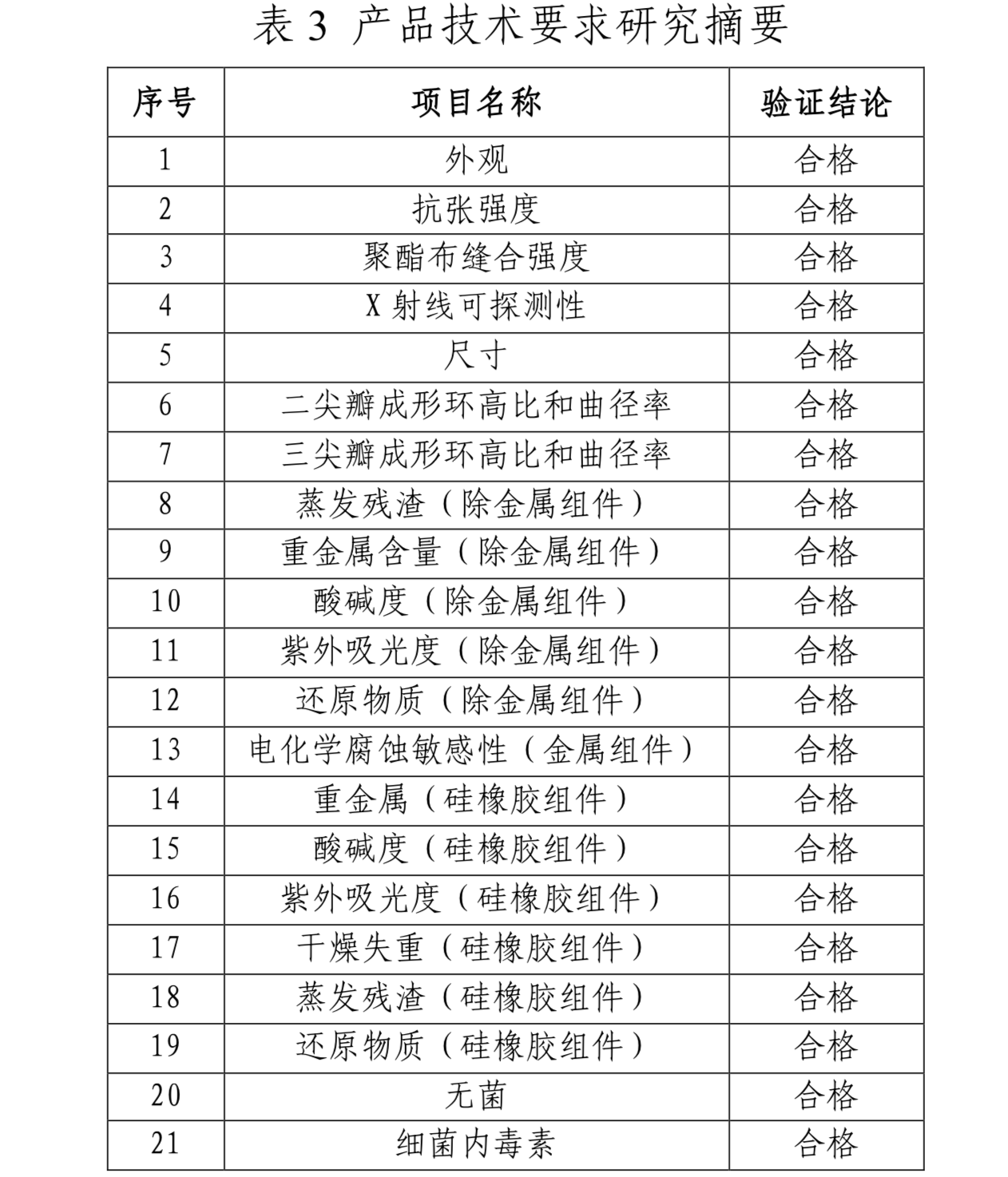
1. 产品技术要求研究
技术要求研究项目如表3所示:
2. 产品性能评价
产品性能评价包括聚酯布筒强度验证、持环器连接强度验证、成形环强度验证、成形环疲劳验证、MRI兼容性、缝合强度、耐腐蚀性等性能验证、对瓣环的内层材质和结构特性的研究、成形环抛光钝化工艺验证、成形环清洗验证、成形环焊接验证、包装风口验证,结果表明产品符合设计输入要求。
(二)生物相容性
该产品包括成形环和持环器两个部分,其中成形环与人体接触方式为持久植入,接触部位为循环血液;持环器短期接触组织。申请人按照GB/T 16886 系列标准进行了生物相容性评价,成形环部件的生物学评价资料主要涉及细胞毒性、溶血、植入、急性全身毒性、皮内刺激、迟发型超敏反应、遗传毒性、亚慢性毒性和体内血栓形成的试验报告;持环器部分的生物学评价资料涉及细胞毒性、皮肤刺激试验、迟发型超敏反应的生物学试验报告。产品的生物相容性风险可接受。
(三)灭菌
该产品采用湿热(蒸汽)灭菌,无菌状态提供。申请人提供灭菌确认报告,证明无菌保证水平为10-6。
(四)产品有效期和包装
该产品有效期为两年。申请人提供了货架有效期验证报告。验证实验为加速老化和实时老化,包括产品稳定性和包装完整性。
(五)动物研究
申请人开展了羊模型的动物实验研究以验证产品安全性和有效性。一共入组了10只羊,其中实验组8只,对照组2只。对照组植入美国爱德华公司的Physio瓣膜成形环(二尖瓣)1枚和EdwardsMC3瓣膜成形环(三尖瓣)1枚。实验组植入4枚二尖瓣瓣膜成形环和4枚三尖瓣瓣膜成形环。实验用动物术后饲养到至少20周到达实验终点。对羊进行的心脏超声检查和血液检查,在到达实验终点时,评价瓣膜成形环结构是否完整、内皮化是否优良、是否有血栓等。结果提示10只羊在到达终点后处死行解剖大体检查,可见实验组和对照组成形环植入位置准确,临近结构未见明显手术损伤;同时实验组和对照组植入的成形环均各层次结构未见破损,纤维鞘完整,平均内皮化率高,均未见血栓。取出脏器后,除实验组1例单发小灶肾梗死外(占肾脏表面积的比例<1%),其余各脏器未见出血、血栓栓塞及梗死改变。
动物实验结论为实验组样品生物安全性优良,未见血栓,内皮化率及脏器栓塞或梗死免除率接近对照组,结合临床试验及动物实验结果,综合评价表明产品达到预期设计要求。
三、临床评价摘要
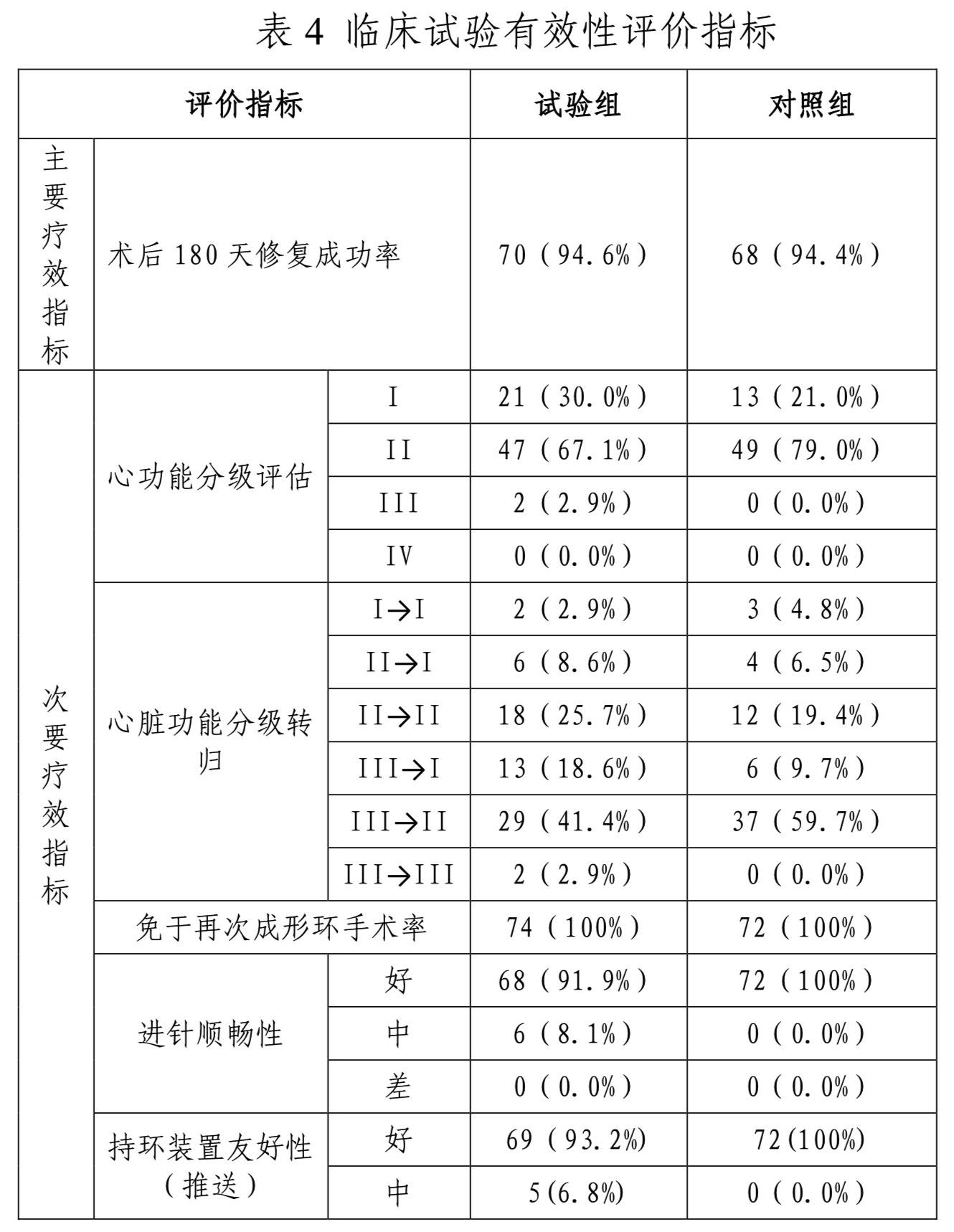
该产品以临床试验方式进行临床评价,为多中心、平行对照、非劣效设计。对照产品为爱德华公司的瓣膜成形环Physio II(二尖瓣成形环,国食药监械(进)字2013第3460801号)和MC3(三尖瓣成形环,国食药监械(进)字2012第3463144号)。主要终点为瓣膜成形环修复成功率(术后180天)。修复成功率为返流程度和径线数值变化综合判定:无重度返流且径线数值变化≤15%。对照组成形环180天的成功率设为96%,假设实验组和对照组同等水平,非劣效界值设为10%。α设为双侧0.05,把握度设为80%,每组至少需要61例,考虑10%的脱离率,每组样本量为68例。共计136例。试验组和对照组的比例为1:1. 次要终点为心脏功能分级(术后180天);术后90天、80天超声心动图检测结果的变化,包括心脏心房心室大小、跨瓣最大压差和平均压差,返向血流基底部宽度和返向血流面积;免于再次成形环手术率(180天);进针顺畅性,持环装置友好性。
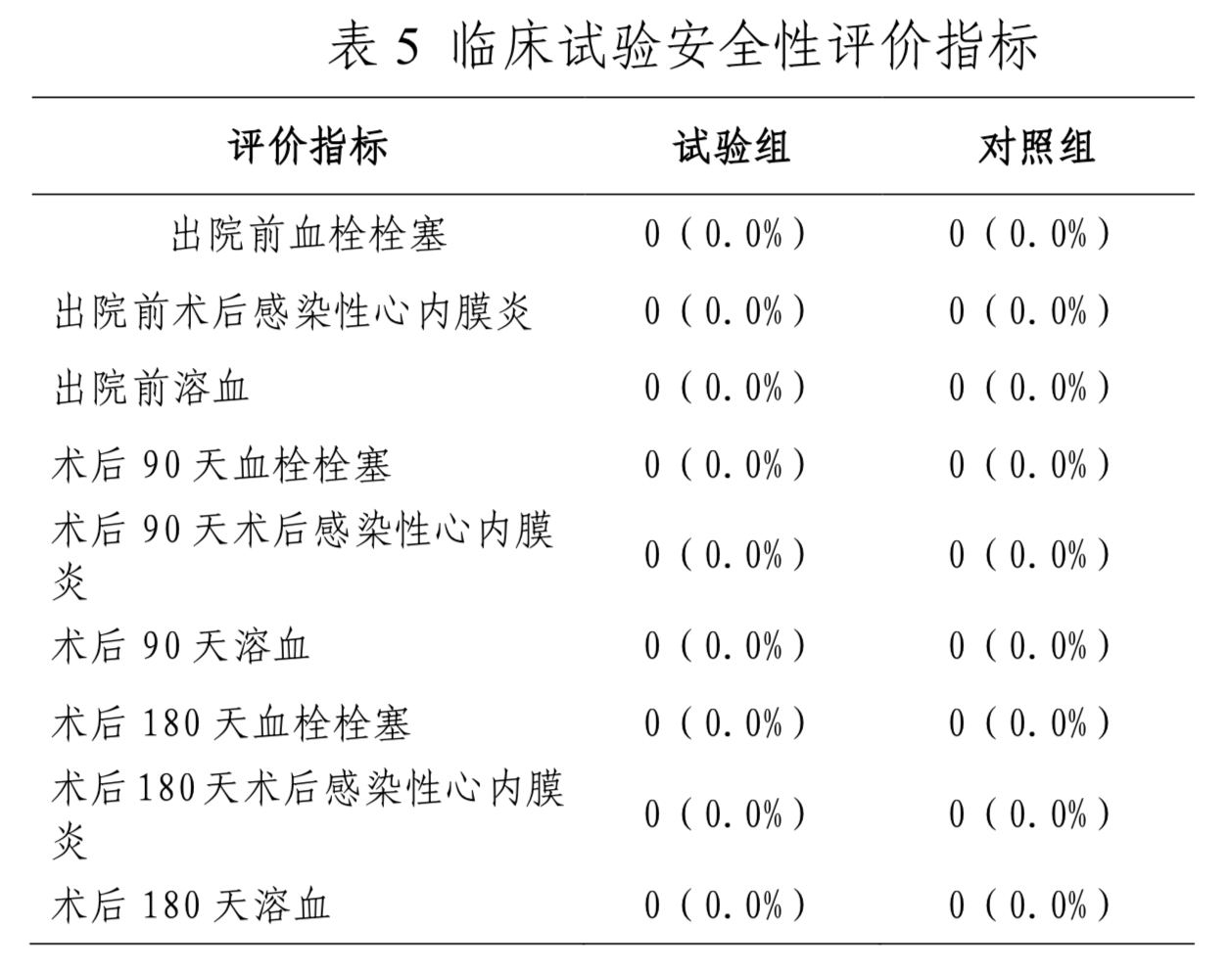
安全性指标为(1)出院前、术后90天、180天并发症:血栓栓塞,术后感染性心内膜炎,溶血;(2)实验室检查(乳酸脱氢酶、凝血三项等的变化);(3)其他不良事件。
该临床试验在4家临床机构开展,分别为首都医科大学附属北京安贞医院(组长单位),河南省人民医院、吉林大学第一医院、新疆维吾尔自治区中医医院。
临床试验入组患者146例,其中试验组74例,对照组72例。全分析集(FAS)人群为146例,符合方案分析集(PPS)为123例,其中试验组66例,对照组57例,安全集(SS)为146例。FAS集主要疗效结果指标缺失按照末次转结法(LOCF)进行填补,修复成功率差值及95%CI为2.4%[-5.8%;11.2%], PPS集修复成功率修复成功率差值及95%CI为2.9%[-7.4%;14.5%],下限大于预先设定的非劣效值-10%,试验组非劣效于对照组。
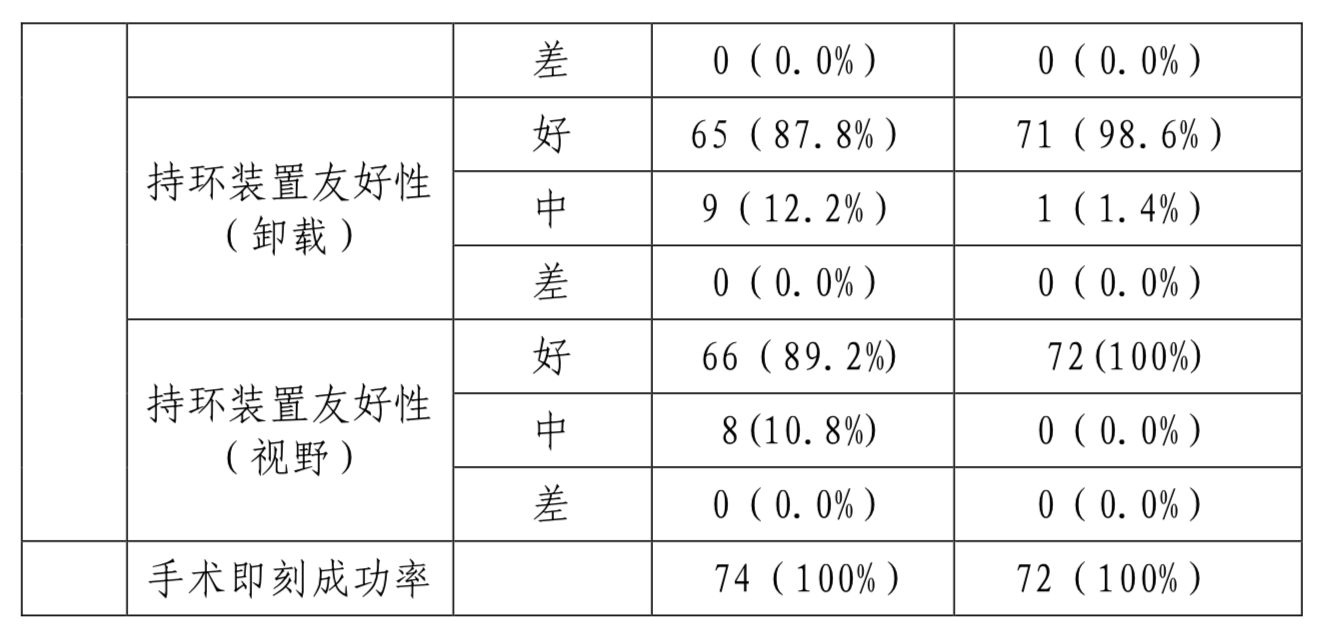
有效性评价指标详见表4。NYHA心脏功能分级(术后180天),试验组和对照组无统计学差异;术后90天、80天超声心动图检测结果的变化,试验组与对照组无统计学差异。
安全性评价指标详见表5。试验期间,两组受试者均未发生血栓栓塞、感染性心内膜炎及溶血事件;实验室检查无器械相关的异常情况。
![]()
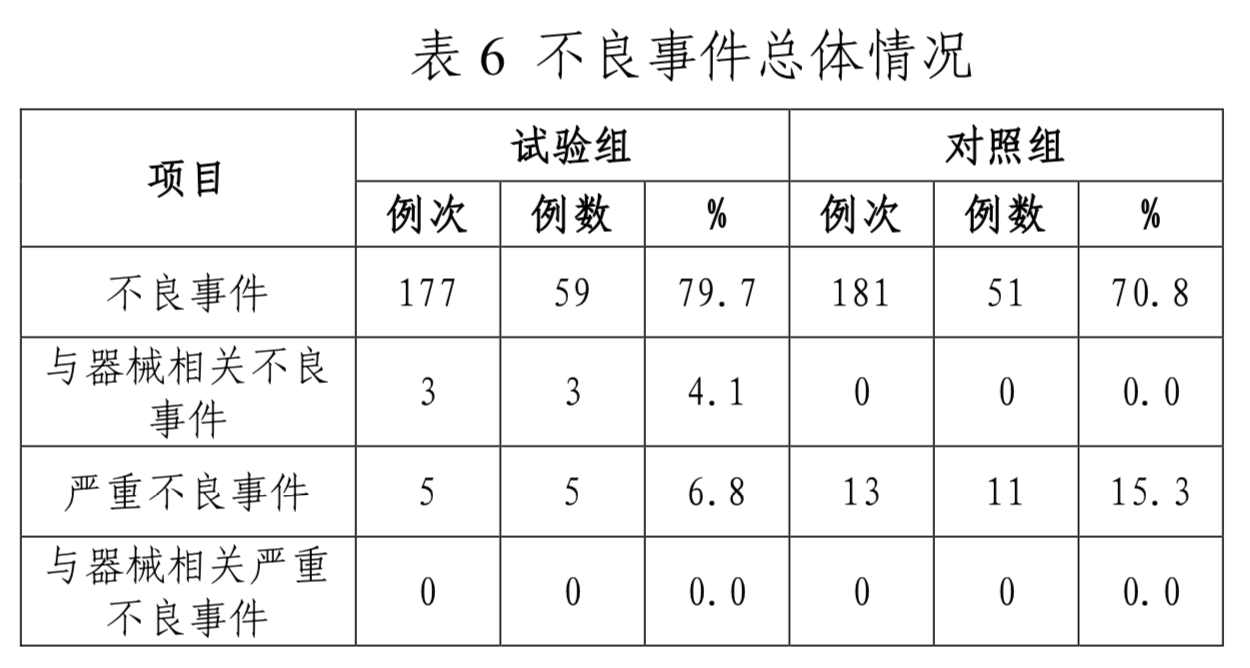
不良事件发生情况如表6所示,试验组和对照组间无统计学差异。试验中,与器械相关性分析结果为试验组和对照组间无统计学差异。
四、风险分析及说明书提示
参照《YY/T 0316-2016 医疗器械风险管理对医疗器械的应用》,对该产品进行风险分析。对目前已知及可预测风险采取了风险控制措施,经综合评价,在目前认知水平上,认为该产品上市带来的获益/受益大于风险。为保证用械安全,需在说明书中提示以下信息:
(一)明确的产品适用范围。
(二)警示及注意事项:
1. 产品为一次性使用,请勿重复使用;
2.如果包装上“有效期”日期已过,请勿使用该成形环。
3.产品的吸塑包装已经过灭菌处理,使用前确保其封口未被打开并完好无损。
4. 植入前,请小心移除序列号标签和标签所带连接线,避免割破或损伤成形环。
5. 缝合时切勿损伤冠状动脉回旋支或右冠状动脉。
6. 缝线不应置于任何心房组织中,以避免因此产生心脏传导损害。
7. 测瓣器出厂时未经灭菌处理,每次使用前必须进行清洗和灭菌处理。请勿使用破损、开裂或变形的测瓣器。
8. 植入时请勿使用角针并避免使用尖嘴金属镊子进行操作,以免损害成形环的外层聚酯布。
9. 缝线时应避开持环器绑线打结处,以保证持环器和绑线能顺利取下。
10. 小心移除任何多余的缝线或线头,避免由此引发的血栓形成或血栓栓塞。
11. 请保持产品形状,勿通过施加外力等手段来使其变形以达到重塑其形状的目的。
12. 在进行牙科或其它可能发生菌血症的操作前,应考虑对患者使用预防性抗生素治疗。 13. 只能使用金仕生物科技(常熟)有限公司提供的测瓣器进行环面尺寸的测量。
(三)禁忌症:
产品禁止用于将来身体生长和发育可能影响有效瓣膜面积的儿童。此外,如果医师确定保留的瓣膜组织或瓣膜支持结构不足以提供必需的血液动力学性能和结构强度,则禁止使用本产品。
综合评价意见
本申报产品属于创新医疗器械特别审批项目,编号2015150。申请人的注册申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令第680号)、《医疗器械注册管理办法》(国家食品药品管理总局令2014年第4号)等相关医疗器械法规与配套规章,经系统评价后,建议准予注册。