附件2
手术电极注册技术审查指导原则
(2017年修订版)
本指导原则旨在指导和规范手术电极产品的注册申报工作,帮助注册人员理解和掌握该类产品的原理/机理、结构、主要风险、性能、预期用途等内容,用来指导注册人员准备和撰写申报资料。同时也可以用来帮助审评人员把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
本指导原则所确定的核心内容是在目前的科技认知水平和现有产品技术基础上形成的,因此,相关人员参考时应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。随着对产品理解的不断深入,本指导原则相关内容也将适时进行调整。
本指导原则不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
一、适用范围
本指导原则适用于与高频发生器配套,仅供开放性外科手术使用的手术电极。手术电极可分为单极手术电极、双极手术电极和中性电极。
根据《医疗器械分类目录》,手术电极归为Ⅱ类医用高频仪器设备,类别代号6825。
按照《关于内窥镜相关产品分类界定的通知》(国食药监械〔2008〕112号)规定“有源内窥镜手术器械:用于在内窥镜下完成手术操作的有源设备,若与高频发生器或其他Ⅲ类设备连接,作为Ⅲ类医疗器械管理,其他产品按照Ⅱ类医疗器械管理”,与内窥镜手术配套使用的高频手术器械应作为Ⅲ类医疗器械管理,不纳入本指导原则的适用范围。
本指导原则中的手术电极不局限于GB9706.4-2009标准中的术语和定义,本指导原则中的手术电极分为单极手术电极、双极手术电极和中性电极。
二、技术审查要点
(一)产品名称要求
手术电极产品的命名应采用《医疗器械分类目录》或国家标准、行业标准中的通用名称,或以产品结构和适用范围为依据命名。应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关法规的要求。
本指导原则包含单极手术电极、双极手术电极和中性电极,可基本参考GB 9706.4-2009《医用电气设备 第2-2部分 高频手术设备安全专用要求》标准中对手术附件、手术电极、双极电极、中性电极的定义。
实际应用中,根据产品的结构和无菌状态,常采用的名称有:(一次性使用)手术电极、单极手术电极、双极手术电极、中性电极(板)。
(二)产品的结构和组成
手术电极根据结构和工作原理的不同,分为单极手术电极、双极手术电极和中性电极。
1.单极手术电极可分为手控单极手术电极和脚控单极手术电极。
手控由电极自身的手控按钮开关控制,脚控需另外配合脚踏开关才能工作。
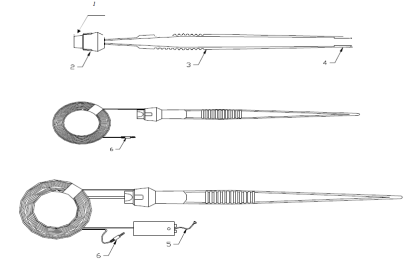
手控单极手术电极可分为非吸引型和吸引型,非吸引型一般由电极、绝缘套管、塑料柄部、手控按钮开关、电缆线、插头组成(见图1)。吸引型一般由电极、功能管、推键、吸引管接头、绝缘套管、塑料柄部、手控按钮开关、电缆线、插头、吸引管组成(见图2)。一般手术电极的可选组件包含保护盒、保护套、护套、清洁片、通条、吸引管接头以及吸引管等可与手术电极配套使用的部件。
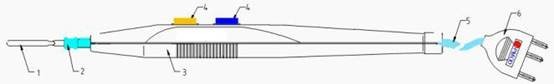
1.电极 2.绝缘套管 3.塑料柄部 4.手控按钮开关 5.电缆线 6.插头
图1 手控非吸引型单极手术电极结构示例图
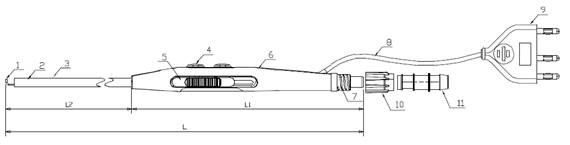
1.电极 2.功能管 3.绝缘套管 4.手控按钮开关 5.推键 6.塑料柄部 7.吸引管接头8. 电缆线 9.插头 10.螺旋帽 11.吸引管
图2 手控吸引型单极手术电极结构示例图
脚控单极手术电极也可分为非吸引型和吸引型,非吸引型一般由电极、绝缘套管、塑料柄部、电缆线及插头组成(图3)。吸引型一般由电极、功能管、绝缘管、电钩手柄、推键、插头、电线、螺旋帽、控制阀柄、短接管接头、长接管接头、旋转接头组成(图4)。
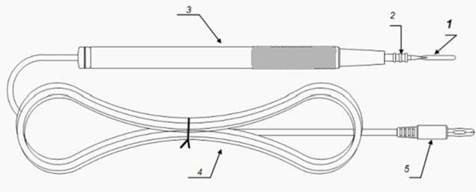
1.电极 2.绝缘套管 3.塑料柄部 4.电缆线 5.插头
图3 脚控非吸引型单极手术电极结构示例图
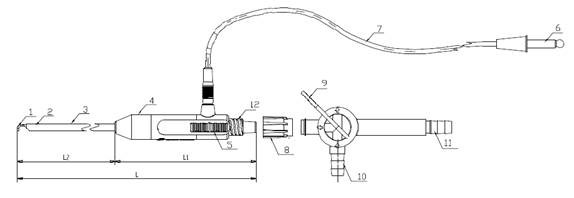
1.电极 2.功能管 3.绝缘管 4.电钩手柄 5.推键 6.插头 7.电线
8.螺旋帽 9.控制阀柄 10.短接管接头 11.长接管接头 12.旋转接头
图4 脚控吸引型单极手术电极示意图
单极手术电极因在手术过程中的使用部位不同,基于各种手术需求的不同,其刀头具有各种不同的形状(见图5)。

图5 手术电极刀头示意图
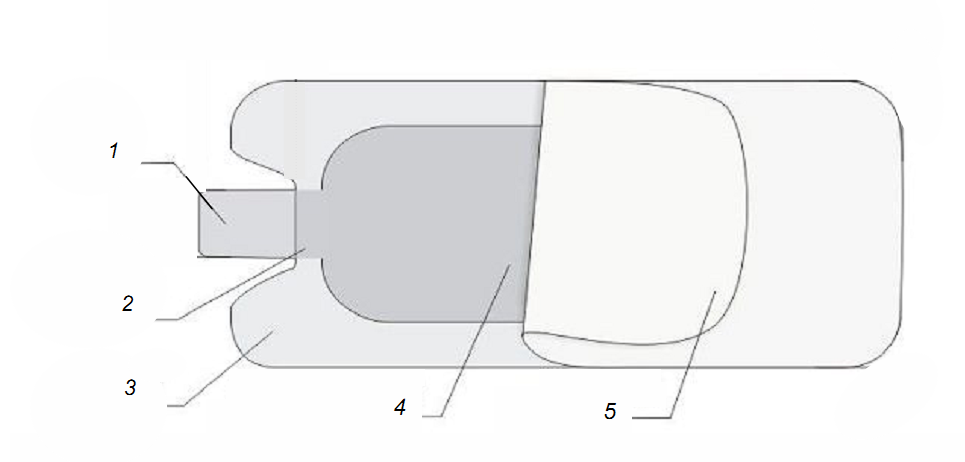
2.双极手术电极,如电凝镊,一般由镊插、镊柄、镊体、镊尖、镊子连线、滴水管(非滴水的无此部件)部件组成(见图6)。
1.镊插 2.镊柄 3.镊体 4.镊尖 5.滴水管 6.镊子连线
图6 双极电凝镊结构示例图
3.中性电极,配套单极手术电极使用,可分为不带监测功能的中性电极和带监测功能的中性电极,一般由舌片、极板主体(常见有压敏胶板面、导电橡胶板面、金属板面)、极板连线组成(见图8、图9)。
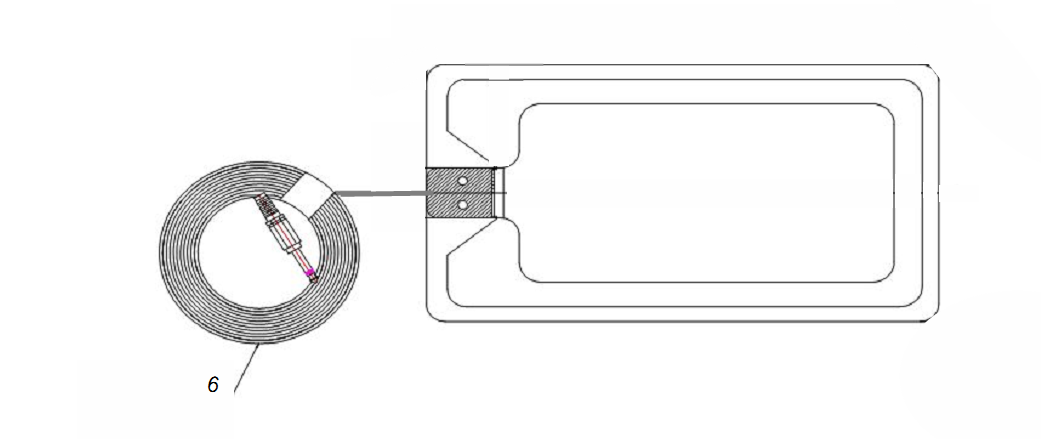
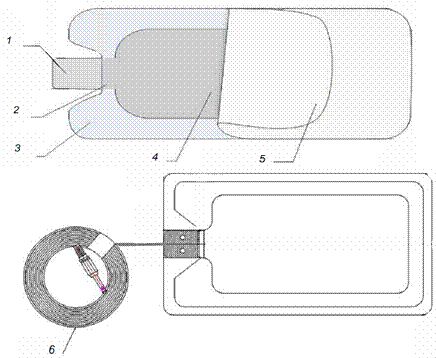
1.舌片 2.铝箔 3.泡棉 4.导电压敏胶 5.隔离纸 6.极板连线
图7 不带监测功能的中性电极结构示例图


图8 带监测功能的中性电极结构示例图
备注:产品结构示意图中的连接器部分的结构形式和安全性要求,应符合GB 9706.4-2009中56.3的要求。
(三)产品工作原理/作用机理
单极手术电极属于高频医疗器械的应用部分,当高频发生器输出一定波形的高频电流时,通过单极手术电极作用于人体组织,并通过人体组织,经过一个分开连接的中性电极回路至高频发生器。
双极电极为两个电极组装于同一支撑物上,当高频发生器输出一定波形的高频电流时,高频电流在两个电极之间流动,直接作用于人体,由双极电极本身的两个电极作为回路,一般不需要中性电极。
中性电极为同患者身体相连接的、具有一个相对较大面积的电极,为高频电流提供一个低电流密度的返回通道,以防止在人体组织中产生不希望的灼伤这类的物理效应,一般配套单极手术电极使用。
手术电极的工作原理和电气连接见图10。
 图10 手术电极的工作原理和电气连接见图
图10 手术电极的工作原理和电气连接见图
该产品与高频手术设备配套,供临床各类外科手术中分别用于组织切割、分离、血管夹闭止血、组织凝固等。
(四)注册单元划分的原则和实例
单极手术电极和双极手术电极可作为一个注册单元进行注册,如:一次性使用手术电极中可以将单极手术电极、双极手术电极作为两个不同的型号。与特定高频主机配套使用的专用型手术电极应该划分为单独的注册单元。中性电极和可监测中性电极可作为一个注册单元进行注册,但应作为两个不同的型号。不同材质的中性电极(如软极板/金属极板、电阻极板/电容极板)应划分为不同的注册单元。一次性使用无菌手术电极与可重复使用的应划分为不同的注册单元。而手术电极和中性电极的结构、工作原理和具体适用范围不同,应分别作为不同注册单元进行注册。
(五)产品适用的相关标准
产品适用的相关标准如表1所示。
表1 相关产品标准
|
标准号 |
标准名称 |
|
GB/T 191-2008 |
《包装储运图示标志》 |
|
GB 9706.1-2007 |
《医用电气设备 第1部分:安全通用要求》 |
|
GB 9706.4-2009 |
《医用电气设备 第2-2部分 高频手术设备安全专用要求》 |
|
GB/T 14233.2-2005 |
《医用输液、输血、注射器具检验方法第2部分:生物学实验方法》 |
|
GB/T 14710-2009 |
《医用电器环境要求及试验方法》 |
|
GB 15980-1995 |
《一次性使用医疗用品卫生标准》 |
|
GB 15981-1995 |
《消毒与灭菌效果的评价方法与标准》 |
|
GB/T 16886.1-2011 |
《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》 |
|
GB/T 16886.5-2003 |
《医疗器械生物学评价 第5部分 体外细胞毒性试验》 |
|
GB/T 16886.10-2005 |
《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》 |
|
GB 18279-2000 |
《医疗器械 环氧乙烷灭菌确认和常规控制》 |
|
GB 18280-2000 |
《医疗保健产品灭菌确认和常规控制要求 辐射灭菌》 |
|
GB/T 19633-2005 |
《最终灭菌医疗器械的包装》 |
|
YY/T 0149-2006 |
《不锈钢医用器械 耐腐蚀性能试验方法》 |
|
YY/T 0294.1-2005 |
《外科器械 金属材料 第1部分:不锈钢》 |
|
YY/T 0316-2008 |
《医疗器械 风险管理对医疗器械的应用》 |
|
YY 0466.1-2009 |
《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》 |
|
YY 0505-2012 |
《医用电气设备 第1-2部分安全通用要求并列标准电磁兼容要求和试验》 |
注: 正文中引用的上述标准以其标准号表述。
上述标准包括了注册产品标准中经常涉及到的标准。不包括根据产品的特点所引用的一些行业外标准或其他标准。
(六)产品的适用范围/预期用途、禁忌症
产品的适用范围应与申报产品的性能、功能相符,并应与临床资料结论一致。
手术电极产品的适用范围一般可限定为:
1.单极手术电极与高频手术设备和/或吸引装置配合使用,在开放性高频手术中进行电凝、电切、吸引。
2.双极手术电极与高频发生器配合使用,在开放性高频手术中对组织进行电凝。
3.中性电极作为高频工作电流的回路。
产品禁忌症要求中应明确不得与内窥镜手术设备配套(通过相同的孔道进入患者体内)使用。
(七)产品的主要风险
手术电极产品的风险管理报告应符合YY/T 0316-2008的有关要求,判断与产品有关的危害,估计和评价相关风险,控制这些风险并监视控制的有效性。
申请者应按照YY/T 0316-2008附录C的34条提示对手术电极产品的安全特征进行判定,并按照YY/T 0316-2008附录E的提示,通过对产品的危害、可预见事件序列和危害处境进行全面分析和评价,并有针对性地实施降低风险的技术和管理方面的措施。
建议关注下列手术电极产品的常见危害:
表2 危害类型及形成因素
|
危害类型 |
形成因素 |
|
|
能量危害 |
电能 |
手术电极外部绝缘/隔离不够,可能引起过量漏电流或电气击穿,伤害使用者或患者 |
|
热能 |
可触及的外壳温度过高,可能引起使用者或患者烫伤 |
|
|
机械能 |
电极前端部位尖锐,造成使用者或患者刺伤。 |
|
|
生物学危害 |
产品生物不相容性 |
设备若有直接与患者接触的组件,接触材料应进行生物相容性评价 |
|
环境危害 |
废物处置 |
使用过的手术电极任意丢弃 |
|
不适当的能量供应 |
高频发生器输出电压不稳定,导致产品不能正常工作 |
|
|
与医疗器械使用有关的危害 |
不适当的操作说明 |
与高频发生器上功能插座不匹配 |
|
消毒袋/无菌包装破损 |
||
|
对非无菌产品使用前未进行消毒/灭菌说明 |
||
|
中性电极板使用时未与人体粘贴可靠 |
||
|
重复使用的电极产品消毒不当引发的风险,如:灭菌液未干而投入使用,可能引起操作者被电击 |
||
|
由未经培训的人员使用 |
对一次性产品重复使用的警告不恰当 |
|
|
对手术电极使用方法不熟悉 |
||
|
信息危害 |
不适当的标记 |
电极外部标记不全面、标记不正确或不能够清楚易认,以及标记不能够永久贴牢 |
|
不完整的说明书 |
说明书中对产品预期用途、禁忌症、副作用等描述不规范、不完整,导致电极的非预期或超范围使用 |
|
|
不适当的操作说明 |
手术间歇存放位置不正确 |
|
|
过于复杂的操作说明 |
||
|
人机工程 |
复杂的控制系统 |
单极电极手控按钮开关有颜色区分其功能,标示不清,导致不适当的操作,不能满足预期要求 |
|
功能失效老化 |
电极寿命终止 |
电极使用寿命规定不明确,电极主要元件失效可能导致产品失控给患者造成危害 |
|
储存、运输不当 |
运输、储存环境条件规定不明确,或未按规定条件运输储存,可能导致电极损坏或不能正常工作 |
|
(八)产品技术要求应包括的主要性能指标
根据手术电极的主要功能和预期用途,产品的技术指标主要包括产品的外观、尺寸、机械性能及接口要求、电气安全性能和电磁兼容性能。不同企业的产品参数根据设计要求会有所区别,并可根据自身产品的技术特点制定性能指标要求。但不得低于相关强制性国家标准、行业标准的要求。
技术要求中规定的要求部分是否齐全,可以通过对是否具有以下主要内容来进行审评:
1.单/双极手术电极
1.1单/双极手术电极性能指标
1.1.1外观及尺寸
单极手术电极:插入部外径(或插入部尺寸,如直径、宽度等)、有效长度(工作部长度)、电极电缆长度
双极手术电极:有效长度(工作部长度)、电极电缆长度
上述内容应符合企业规定要求。
1.1.2物理指标
手术电极应用部分的硬度、电极表面粗糙度应符合企业规定要求。
1.1.3接口电气可靠性要求
电极导通性:手术电极与高频连接线应导通良好,其阻抗值应小于企业规定值。
1.1.4材料
应明确产品的材料,尤其是直接接触人体的材料(金属材料、高分子材料等),应规定材料耐腐蚀性指标。
2.中性电极
2.1中性电极性能指标
2.1.1外观及尺寸
中性电极电缆长度、电极板尺寸应符合企业规定要求。
3.其他性能指标
3.1一次性使用产品要求
3.1.1无菌产品
应无菌;采用环氧乙烷灭菌的产品,要求产品出厂时环氧乙烷残留量不得大于10μg/g。
3.1.2以非无菌状态使用的产品,其初始污染菌应不得大于100cfu/件,并不得检出致病菌。
3.2重复使用产品要求(应在说明书中明确符合重复使用产品材料特性的灭菌方法及灭菌方法耐受性要求)
3.3耐腐蚀性要求
采用马氏体或奥氏体不锈钢材料制成的手术电极产品,其耐腐蚀性应能达到YY/T 0149-2006中沸水试验法规定的b级要求;若采用其他材料制成的手术电极产品,其耐腐蚀性应满足在常规条件下,经消毒灭菌不得产生锈蚀现象(检验用消毒灭菌方式应与说明书规定的消毒灭菌方式一致)。
3.4附加功能
产品如有附加功能,应满足企业规定要求。
3.5电气安全
单极手术电极、双极手术电极和中性电极自体是无源产品,然而该产品必须配合高频发生器设备使用,因此需满足GB 9706.1-2007和GB 9706.4-2009的互连要求以及相适应条款的要求。
3.6电磁兼容性(如包含线缆)
应符合YY 0505-2012及GB 9706.4-2009第36章的要求。产品的试验方法应根据技术性能指标设定,试验方法一般应采用已颁布的标准试验方法,如果没有现行的标准试验方法可采用时,规定的试验方法应具有可操作性和可再现性。电气安全性能的检测主要参照GB 9706.1-2007和GB9706.4-2009。电磁兼容性的检测参照YY 0505-2012。
手术电极同一注册单元内所检测的产品应当是能够代表本注册单元内其他产品安全性和有效性的典型产品。原则上应选择结构最复杂、功能最多的型号作为典型型号进行注册检验,若性能指标不能互相覆盖,则典型产品应为多个型号。
同一注册单元内单极手术电极和双极手术电极应分别选取典型型号进行注册检验,不能互相覆盖。
同一注册单元内中性电极和可监测中性电极应分别选取典型型号进行注册检验,不能互相覆盖。
1.根据产品设计方案,明确产品工艺流程,要求企业提交工艺流程图,标明产品关键工序和过程控制点。如:产品的主要工艺有组装、铆接、焊接、测试等工序,其中焊接为关键工序。
2.应要求企业提交研制、生产场地的相关信息,如:场地平面图。如有多个研制、生产场地,应当概述每个研制、生产场地的实际情况。
根据《关于发布免于进行临床试验的第二类医疗器械目录的通告》(国家食品药品监督管理总局通告2014年第12号)(以下简称目录),“产品名称:高频手术电极(电刀笔、电凝钳、电凝剪、电凝镊),分类编码:6825”包含在免于进行临床试验的第二类医疗器械目录中,注册申请人需按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号附件)的要求,将申报产品与目录中的产品信息进行对比评价,若申报产品属于是属于目录,则可根据如下要求提交评价资料:
1.提交申报产品相关信息与《目录》所述内容的比对资料;
2.提交申报产品与《目录》中境内已上市同品种医疗器械的比对说明,进行比对并提供数据的内容应当包括但不限于:预期用途、基本原理、与人体接触部分的制造材料、使用方法、产品结构、主要技术指标、灭菌方式、其他功能等,并提供相应支持性资料。
如果不能证明产品与目录中的产品具有等同性,则应按照《医疗器械临床评价技术指导原则》中的其他评价路径,提交临床评价资料。
(十二)产品的不良事件历史记录
根据国家食品药品监督管理局药品不良反应监测中心近年来有关手术电极发生医疗器械不良事件主要有灼伤、烫伤和旋切器刀头断裂,原因主要是手术电极按扭开关失灵和刀头材料的质量问题。中性电极发生医疗器械不良事件主要有接触电极片处的皮肤发红、电极板胶体脱落。从不良事件的调查情况来看,手术电极产品在临床上比较容易出现的问题是开关和按钮的设计以及质量问题存在安全隐患。目前,国外该类产品未发现严重安全问题。
(十三)产品说明书和标签要求
手术电极产品的说明书和标签应符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局局令第6号)、YY 0466.1-2009、GB 9706.1-2007和GB 9706.4-2009、YY 0505-2012中的相关要求。说明书、标签的内容应当真实、完整、科学,并与产品特性相一致,文字内容必须使用中文,可以附加其他语种。说明书、标签中的文字、符号、图形、表格、数据等应相互一致,并符合相关标准和规范要求。
1.产品说明书
1.1产品名称、型号、规格;
1.2注册人的名称、住所、联系方式及售后服务单位,进口医疗器械还应当载明代理人的名称、住所及联系方式;
1.3生产企业名称、注册地址、生产地址、联系方法;
1.4生产企业许可证编号和注册证书编号;
1.5产品技术要求的编号;
1.6产品的性能、主要结构、适用范围;
1.7禁忌症、注意事项以及其他需要警示或提示的内容;
1.7.1手术电极使用前请检查失效期,若为无菌一次性使用产品,则包装破损,严禁使用,重复使用产品应检查消毒灭菌状态标识。
1.7.2单极手术电极如与中性电极配合使用,手术过程中应注意电路监视,防止灼伤。
1.7.3患者不应与接地的或者可见的对地电容的金属部件(如:手术台、支架等)接触,建议使用抗静电板。
1.7.4应避免皮肤对皮肤的接触。如:患者手臂和身体间衬垫一块干纱布。
1.7.5中性电极板不得粘贴在皮肤破损部位。
1.7.6手术电极电缆应避免与患者或其他导线接触。暂时不用的手术电极应和患者隔开安放。
1.7.7在正常的工作设定时,输出明显降低或外科设备不能正常工作,可能说明为中性电极接触不良或使用不当。
1.7.8进行高频手术前,应该将易燃的清洁剂或粘结剂的溶剂蒸发掉。在使用设备前必须擦掉存在于患者身下或人体凹处(如脐部)和人体腔中(阴道内)的易燃性液体积液。必须对内含气体着火的危险引起注意。某些材料,如充满了氧气的脱脂棉、纱布在正常使用中,可能被设备正常使用产生的火花引起着火。
1.7.9高频电流可能对心脏起搏器的工作有干扰,应注意电流回路不得通过心脏起搏器等患者佩戴的有源植入产品。
1.7.10手术电极的清洗、消毒、灭菌和定期维护还需要根据各个医院的实际情况和厂家的建议执行。
1.8医疗器械标签所用的图形、符号、缩写等内容的解释;
1.9安装和使用说明或者图示;
1.10无菌标识和灭菌方法(无菌产品适用);
1.11一次性使用的标识(一次性使用产品适用);
1.12清洗、消毒、灭菌方式(重复使用产品适用);
1.13可接受的重复使用次数(重复使用产品适用);
1.14产品的储存条件;
1.15产品的生产日期,使用期限或失效期;
1.16说明书的编制或者修订日期;
1.17使用说明书应向使用者或操作者提供有关存在于该设备与其他装置之间的潜在的电磁干扰或其他干扰的资料,以及有关避免这些干扰的建议,如:明确不要在强电磁条件下使用或是明确参见配套高频发生器要求。
技术说明书一般应包括产品概述、组成、原理、技术参数、规格型号、图示标记说明、外形图、结构图、按键的形式及显示方式,必要的电气原理图及表等。
2.标签和包装标识。至少应包括以下信息:
2.1生产企业名称;
2.2产品名称和型号;
2.3医疗器械注册证书编号;
2.4产品编号或生产日期、生产批号;
2.5灭菌方法(无菌产品适用);
2.6包装破损,禁止使用的标示(无菌产品适用)。
(十四)产品的研究要求
1.产品性能研究
应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。如:手术电极头部的硬度、电极表面粗糙度参数确定的研究资料。
2.生物相容性评价研究
(1)产品生物相容性评价依据为GB/T 16886.1-2011、GB/T 16886.5-2003、GB/T 16886.10-2005标准。
(2)电极工作部与患者人体组织短期接触,接触的部位一般采用不锈钢材料制成,部分产品如对不锈钢材料进行镀层,需对镀层进行生物相容性评价。
(3)实施或豁免生物学试验的理由和论证可参照《医疗器械生物学评价和审查指南》中相关要求。
(4)根据生物学试验结果或已有信息(包括材料、文献资料、体外和体内试验数据、临床经验)判断与人体接触部分材料是否具有安全的生物学特性。
3.灭菌/消毒工艺研究
以无菌方式提供的手术电极,企业应明确相应的灭菌工艺(包括灭菌方式和相关参数)和无菌保证水平(SAL),提交灭菌确认报告。以非无菌方式提供的手术电极,企业应向终端用户明确产品的灭菌工艺(包括灭菌方式和相关参数及确定依据)
4.产品有效期和包装研究
(1)企业应提交产品有效期研究确认资料,如:可参考国标《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》(YYT 0681.1-2009)对产品外包装,产品本身或电子器件等关键物料采用加速寿命试验和实时老化试验的方式验证其有效期。
(2)以非无菌状态提供,并允许重复使用的完全采用不锈钢制造的手术电极应提供使用次数验证资料,如:依据产品工作条件、金属材料特性及疲劳程度分析等方面进行验证。
(3)企业应提交包装研究资料,应明确包装形式、包装材质、研究确认方案、试验结果及结论。
三、审查关注点
(一)应关注注册单元中,产品各个型号的关键结构组成、工作原理、适用范围,同一注册单元产品的以上项目应基本相同。
(二)应关注产品适用的相关标准是否齐全,是否为现行有效版本。
(三)应关注产品结构组成中,是否有在实际使用过程中,会接触患者的部件,应对此类部件进行生物相容性评价。
(四)应关注注册检验报告是否覆盖所有性能要求的检验,覆盖的性能指标是否为最高要求,注册检验报告所附照片中的产品结构组成、标识标签等信息,是否与其他申报资料描述相同。
(五)应关注临床试验资料中,对比同类产品的关键结构组成、工作原理、适用范围是否与申请注册产品一致。
(六)应关注产品使用说明书适用范围是否与临床结论一致,不能宣称临床试验结论以外的其他的预期用途,也不能对临床试验结论进行扩大或改变;应明确产品配套使用产品的要求,包括取得医疗器械注册证、具体型号规格等;产品禁忌症应在说明书中给出,应明确禁止与内窥镜手术配套使用。
手术电极注册技术审查指导原则修订说明
(一)修订背景
随着新的《医疗器械监督管理条例》及配套法规的发布和实施,以及与此类产品相关的国家标准、行业标准的修订改版和相关新标准的发布,同时按照国家食品药品监督管理总局要求,需要对本指导原则进行修订。
(二)修订目的
1.本指导原则修订的目的是为了能够满足新法规、新标准的要求,并用于指导和规范手术电极产品注册申报过程中审查人员对注册材料的技术审评,同时也可用来指导注册申请人对手术电极产品注册申报资料的准备及撰写。
2.本指导原则旨在让初次接触该类产品的注册审查人员对产品机理、结构、主要性能、预期用途等各个方面有个基本了解,同时让技术审查人员在产品注册技术审评时把握基本的要求尺度,以确保产品的安全、有效。
二、指导原则修订的依据
(一)《医疗器械监督管理条例》(国务院令第650号)
(二)《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
(三)《医疗器械临床试验规定》(国家食品药品监督管理总局令第5号)
(四)《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)
(五)《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)
(六)《关于发布医疗器械产品技术要求编写指导原则的通告》(国家食品药品监督管理总局通告2014年第9号)
(七)《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第43号)
(八)食品药品监管总局关于印发《境内第二类医疗器械注册审批操作规范的通知》(食药监械管〔2014〕209号)
(九)国家食品药品监督管理部门发布的其他规范性文件
三、指导原则主要修订内容
(一)根据GB 9706.4-2009中“中性电极”术语中的定义,增加了可监测中性电极。
(二)产品的结构和组成内容中,增加了单极手控带吸引手术电极和单极脚控带吸引手术电极的结构组成和示意图,以增加审评人员的感性认识。
(三)注册单元划分方面,从原来的单极、双极需分开为不同注册单元注册更改为单极手术电极和双极单极电极可作为一个注册单元进行注册。
(四)在产品的使用标准中增加了GB 18279-2000、GB 18280-2000、GB/T 19633-2005、GB/T 16886.5-2003、GB/T 16886.10-2005五个国家标准的引用,同时删除了与产品性能要求无关的行业标准《医用电气设备 第1-8部分:安全通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南》(YY 0709-2009)。
(五)在产品的主要技术指标中,将手术电极性能指标中的电气安全性能从以GB 9706.1-2007和GB 9706.4-2009中相适应条款逐条列出更改为需满足GB 9706.1-2007和GB 9706.4-2009的互连要求以及相适应条款的要求,同时增加了电磁兼容性的要求。
(六)产品的预期用途采用了GB 9706.4-2009标准中“2.1.103 手术电极”规定的表述方式,并结合已批准上市产品的核准范围、公开出版的临床医学文献的描述和临床专家的意见。
(七)说明书中增加了电磁兼容提示信息要求。
(八)产品不良事件历史记录的修改主要通过我省不良事件监测机构查询和了解。
四、指导原则制修订单位
浙江省医疗器械审评中心。